Il silenziamento genico per la MH: la storia fino ad ora
Il silenziamento genico per la MH è cosi promettente come sembra, e che cosa ci potrebbe riservare il futuro?
 Di Professor Ed Wild 19 settembre 2012 Tradotto da Panel Traduttori Volontari di AICH-Roma ONLUS A cura di Dr Jeff Carroll Articolo pubblicato per la prima volta 22 marzo 2011
Di Professor Ed Wild 19 settembre 2012 Tradotto da Panel Traduttori Volontari di AICH-Roma ONLUS A cura di Dr Jeff Carroll Articolo pubblicato per la prima volta 22 marzo 2011
Con silenziamento genico si intende l’uso di speciali molecole progettate per ‘ spegnere’ il messaggio che permette alle cellule di produrre al proteina huntingtina dannosa. La nostra introduzione sul silenziamento geniico su HDBuzz spiega le tecniche, i risultati ottenuti fino ad ora e le prossime sfide.
Abbiamo avuto molte richieste da parte dei nostri lettori di scrivere un articolo sul ‘silenziamento genico’ noto anche come ‘ silenziamento dell’ huntingtina’. E’ una area di ricerca che sta generando molto entusiasmo. L'attenzione di molte persone si è rivolta verso questo argomento dopo i recenti comunicati stampa rilasciati congiuntamente dalla Lundbeck e dall’ Università del Massachusetts in cui si annunciava una collaborazione scientifica mirata allo sviluppo di terapie di interferenza RNA (RNAi)‘ per la MH.
Allora, che cos'è il silenziamento genetico? Come funziona, e come potrebbe essere utile per i pazienti con la MH?

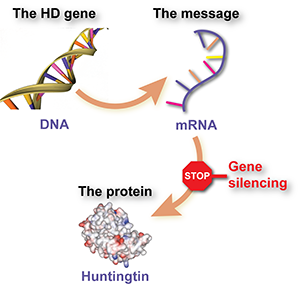
Geni, messaggi e proteine
Le Proteine sono delle molecole che agiscono come delle piccole macchine che eseguono molti lavori utili all'interno delle cellule- lavori come far funzionare le reazioni chimiche, comunicare messaggi, dare alle cellule la loro struttura e cosi via. Ogni proteina è costruita usando un insieme di istruzioni chiamate geni. I Geni sono fatti con il DNA e si trovano nel centro di controllo della cellula, il nucleo.
I geni tuttavia non sono direttamente usati per costruire le proteine. In un passaggio intermedio, la cellula usa la sequenza DNA del gene come uno schema per realizzare una ’ molecola messaggera’ chiamata ‘RNA messaggero’ o mRNA. La molecola messaggera mRNA viene quindi utilizzata per dire alla cellula quali mattoncini bisogna unire insieme per costruire la proteina.
Per riepilogare, il DNA è usato come uno schema per costruire una molecola messaggera mRMA e la molecola messaggera è quindi usata per costruire le molecole delle proteine.
La malattia di Huntington è causata da un singolo gene anomalo - il gene che dice alla cellula di produrre la proteina chiamata huntingtina. Ciascuna cellula ha due copie di ogni gene. Molte persone con la MH, o coloro che la svilupperanno in futuro, hanno un gene normale e l'altro con un eccesso di ripetizioni della sequenza di tre lettere ‘CAG’ vicino all'inizio. Questo semplice ‘ errore di scrittura ’ produce una proteina ‘ mutata ’ che si comporta in maniera differente dalla proteina normale, danneggiando le cellule e producendo i sintomi della MH.
Potresti aver sentito il termine *‘ wild type’ *- cosi è come i ricercatori chiamano il gene e la proteina non mutati o normali.
Il silenziamento del gene della huntingtina
Visto che il gene anomalo è la causa di tutti i problemi nella MH; perché semplicemente non ce ne disfiamo e lo sostituiamo con un gene sano? Purtroppo questo è poco probabile che funzioni perché le cellule hanno dei metodi sicuri per proteggere il DNA in modo da prevenirne danneggiamenti o modificazioni.
La molecola messaggera mRNA, d'altro lato, circola all'interno della cellula e, fino a quando rimane lì, viene utilizzata per produrre le molecole delle proteine. Se potessimo dire alla cellula in qualche modo di ignorare quel messaggio, la proteina dannosa non sarebbe più prodotta. Questa è il ragionamento alla base del ‘silenziamento genico’ L'idea è che gli scienziati potrebbero creare un farmaco che si comporta come una molecola messaggera appositamente realizzata che si attacca al messaggio relativo alla huntingtina e dice alle cellule di ignorarlo.
Il silenziamento genico sembra troppo bello per essere vero, ma non è cosi. Nel 1998, due ricercatori, che stavano per vincere il premio Nobel per la Medicina, lavoravano su come spegnere singoli geni. Chiamarono la loro tecnica di interferenza RNA (RNAi).
Il silenziamento genetico è ora una tecnica standard usata dai ricercatori per studiare come l'organismo funziona, come le malattia producono danno e come strumento per sviluppare trattamenti. L'uso di un farmaco per il silenziamento genetico (il Vitravene, usato per il trattamento di una infezione virale dell'occhio) è autorizzato per l'uso su pazienti umani, e più di una dozzina di sperimentazioni sono in corso su diverse malattie e altre ancora sono in vista.
Se fosse cosi facile, dovremmo gia avere pillole per il silenziamento genico dela malattia di Huntington, per cui qual'è il tranello? Ebbene, come con altre tecniche nuove è inevitabile che ci siano delle sfide, contrattempi e ostacoli inattesi lungo la via.
Sfida numero uno: entrare nel cervello
Uno dei problemi principali è quello di portare le molecole per il silenziamento dove serve. Nella MH, la morte delle cellule celebrali chiamate neuroni è il problema principale, quindi dobbiamo portare le molecole dentro queste cellule.
Il primo ostacolo è introdurre il farmaco nel cervello. Il cervello ha uno una barriera difensiva naturale che impedisce l'ingresso delle sostanze nocive contenute nel sangue. Per noi tutti questo è positivo perché protegge il cervello, ma ai ricercatori di farmaci per la MH fa venire il mal di testa perché rende più difficile l'ingesso delle medicine nel cervello in confronto ,tanto per dire, al fegato o ai reni.
«Molti gruppi differenti di ricercatori hanno comunicato i loro successi nel ridurre la produzione di huntingtina in modelli animali. »
E’ quindi improbabile che una semplice pasticca o una iniezione potrebbe essere utile per combattere la MH con il silenziamento genetico. Una alternativa per risolvere questo problema è di usare delle pompe e dei tubicini per iniettare il farmaco del silenziamento direttamente nel cervello nel fluido che lo circonda- il fluido celebrospinale o CSF. Questo sembra abbastanza scoraggiante e non c'è dubbio che impiantare tubi e pompe nel sistema nervoso è una grande sfida, ma sistemi simili sono attualmente usati per il rilascio di farmaci per altre malattie come la sclerosi multipla (MS) o tumori del cervello in maniera ben sicura.
Sfida numero due: la distribuzione
Una volta che il farmaco è nel sistema nervoso, il problema della distribuzione non è ancora risolto. Il cervello è un agglomerato denso di un tessuto che per le molecole del silenziamento è difficile da attraversare. Inoltre, il trattamento per funzionare ha bisogno di entrare all'interno delle cellule- galleggiare tra le cellule non è abbastanza.
Gli scienziati stanno usando metodi differenti per risolvere il problema. I vincitori del Premio Nobel hanno usato molecole ad interferenza di RNA (RNAi) per spegnere i geni. Queste sono molto simili alle molecole prodotte naturalmente dal cervello. L'inconveniente è che queste non si diffondo naturalmente nel cervello e non sono molto capaci di entrare nelle cellule.
I ricercatori della RNAi tendono ad ad usare dei tubi sottili inseriti nella materia cerebrale mirando alle parti più danneggiate, connesse a pompe che utilizzavano la pressione per diffondere ulteriormente il farmaco. Un'altra possibilità è di permettere alle molecole RNAi di ‘farsi dare un passaggio’ all'interno di virus disattivati che sono capaci di muoversi all'interno del cervello e di iniettare materiale dentro le cellule.
Un altro approccio ancora è di provare altre molecole che potrebbero essere migliori nel diffondersi intorno ed entrare nel cervello. Le molecole di oligonucleotidi antisenso(ASOs) sono simili alle molecole RNAi ma sono leggermente più semplici e non sono prodotte dalle cellule per vie naturali. Il principio è lo stesso- si attaccano alle molecole messaggere mRNA e impediscono alle cellule di utilizzarle per produrre proteine.
Gli ASO sembrano migliori nel diffondersi nel cervello e possono entrare nelle cellule abbastanza facilmente. Inoltre sembrano durare più a lungo- il che potrebbe essere una buona o cattiva cosa a seconda di quanto bene svolgono l loro compito.
Quale tecnica di silenziamento genetico è migliore? Semplicemente non lo sappiamo. Sappiamo solo che le molecole RNA e ASO sono attualmente impiegate allo stesso tempo per capire quale sia migliore.
Sfida numero tre: spegnere il gene
La prova chiave di un trattamento con silenziamento genico è se può silenziare con successo il gene. Fino ad ora, la ricerca sulla MH condotta su modelli animali ha fortemente suggerito che questo risultato può essere raggiunto con entrambi i trattamenti, RNAi e ASO.
Nel 2005, un gruppo di ricercatori guidati da Bev Davidson nello Iowa hanno iniettato molecole RNAi nel cervello di roditori MH ottenendo una riduzione dell’ 85% del messaggio dell'huntingtina. Anche le funzioni motorie e le anomalie cellulari dei topi sono migliorati. Da allora, differenti gruppi di ricercatori hanno riportato successi nell'abbassamento del livello di produzione di huntingtina usando diversi tipi di molecole inclusi i farmaci a base di RNAi e ASO. Il lavoro più recente suggerisce l'idea che i benefici di anche a piccole somministrazioni perdurano per un periodo abbastanza lungo.
Sfida numero quattro: scegliere l'obiettivo giusto.
Ai ricercatori di farmaci piace individuare i problemi prima che questi insorgano e uno dei possibili problemi con il silenziamento genetico è il suo effetto sulla copia naturale o wild-type del gene della huntingtina.
Sappiamo che non avere affatto l'huntingtina è pericoloso. Topi senza entrambe le copia del gene sono morti prima della nascita. Allora la domanda chiave è:la riduzione della huntigtina mutata che è necessaria per trattare la malattia produce anche una riduzione della huntingtina wild type che è pericolosa?
Al momento non lo sappiamo. Alcuni ricercatori credono che piccole riduzioni della huntingtina mutata saranno sufficienti per dare la possibilità alle cellule di recuperare e quindi non ci dobbiamo preoccupare degli effetti dannosi dovuti al leggero abbassamento della proteina wild-type. Altri pensano che è necessario sviluppare trattamenti in grado di spegnere solo la proteina mutata. Questo è chiamato silenziamento allele-specifico, un allele è come chiamiamo ognuna delle due copie di un gene.
Il silenziamento genico allele-specifico sembra essere molto sensibile- se possiamo mirare a un gene mutato perché non dovremmo? L'inconveniente è che per mirare a solo una delle due copie del gene bisogna controllare il DNA di ciascun paziente per trovare le specifiche differenze nella ‘ortografia’ dei due geni. Fortunatamente, queste differenze sono comuni ma probabilmente avremo bisogno di differenti farmaci in modo da fornire trattamenti mirati a più pazienti possibili. Alcuni pazienti non presentano differenze di scrittura tali da essere bersagliate in questa maniera.
La discussione sulla necessità del silenziamento allele-specifico è in corso ma la buona notizia è che non dovremmo aspettare a lungo per una risposta perché entrambe le tecniche stanno proprio ora per essere testate da differenti gruppi di ricercatori.
Sfida numero cinque: gli effetti collaterali
I trattamenti di silenziamento genetico potrebbero avere effetti collaterali anche se i possibili problemi derivanti dall'abbassamento della huntingtina wild-type possono essere evitati.
Un problema è chiamato ‘ effetti fuori-obiettivo’ dove il farmaco si attacca ed interferisce con molecole messaggere di geni diversi dalla huntingtina. Questo potrebbe produrre un certo numero di problemi.
Un altro problema è che il sistema immunitario del cervello potrebbe combattere le molecole ‘aliene’ che sono state pompate all'interno il che potrebbe peggiorare le cose.
Dobbiamo prendere in seria considerazione ora questi possibili effetti collaterali mentre li stiamo valutando su modelli animali. Persino piccoli effetti indesiderati possono essere cattive notizie specialmente se il silenziamento genico dovrà essere usato per molti anni per prevenire i sintomi nelle persone che hanno avuto un test positivo.
I ricercatori stanno lavorando per produrre molecole migliori con il più basso rischio di seri effetti collaterali e solo le più sicure saranno proposte per la sperimentazione umana.
Quando, quando, quando ?
L'entusiasmo sul silenziamento genico è giustificato perché molti ricercatori credono che questa sia la migliore possibilità per produrre trattamenti efficaci per la MH. Ci sono chiaramente molti problemi da risolvere ma ogni anno che passa vengono fatti dei progressi e tutti sono d'accordo che nulla di quello che è stato scoperto fino ad ora suggerisce che la tecnica non funzionerà su pazienti.
Proprio ora una nuova sperimentazione sul silenziamento genico ASO è in corso su pazienti con SLA (malattia del motoneurone). Questo è veramente importante perché viene testato non solo il farmaco ma anche il sistema di somministrazione di tubicini e pompe per far arrivare il farmaco la dove è necessario. Nel frattempo, molti ricercatori in tutto il mondo stanno scoprendo quali molecole saranno le più adatte per essere testate su pazienti con la MH.
Non possiamo dire con sicurezza quando i trattamenti per il silenziamento genico saranno disponibili per i pazienti ma HDBuzz sarebbe deluso se non si vedranno delle sperimentazioni di silenziamento genico per la MH su pazienti umani nel prossimo vicino futuro.
Tradotto da:
Stefano Paoloni
Membro del Panel Traduttori Volontari di AICH-Roma ONLUS


